Ärftlig icke-polypos kolorektal cancer (HNPCC), även kallad Lynch syndrom, är ett autosomalt dominerande genetiskt tillstånd som är associerat med en hög risk för koloncancer såväl som andra cancerformer inklusive endometriecancer (näst vanligaste), äggstockar, mage, tunntarm, lever och gallvägar, övre urinvägar, hjärna och hud. Den ökade risken för dessa cancerformer beror på ärvda mutationer som försämrar reparation av DNA-fel. Det är en typ av cancersyndrom.
Symtom på Lynch syndrom
Risk för cancer
Livstidsrisk och medelålder vid diagnos för cancer i samband med Lynch-syndrom
| Typ av cancer | Livstidsrisk (%) | Medelålder vid diagnos (år) |
| Kolorektal | 52-58 | 44-61 |
| Endometrial | 25-60 | 48-62 |
| Mag | 6-13 | 56 |
| Ovarian | 4-12 | 42,5 |
Förutom de typer av cancer som finns i diagrammet ovan, är det underförstått att Lynch syndrom också bidrar till en ökad risk för tunntarmscancer, bukspottkörtelcancer, urinledare / njurbäckkreft, gallvägscancer, hjärncancer och talgsvulst. Ökad risk för prostatacancer och bröstcancer har också förknippats med Lynch syndrom, även om detta förhållande inte är helt klart.
Två tredjedelar av tjocktarmscancer uppträder i den proximala tjocktarmen och vanliga tecken och symtom inkluderar blod i avföringen, diarré eller förstoppning och oavsiktlig viktminskning. Medelåldern för diagnosen kolorektal cancer är 44 för familjemedlemmar som uppfyller Amsterdam-kriterierna. Medelåldern för diagnos av endometriecancer är cirka 46 år. Bland kvinnor med HNPCC som har både tjocktarmscancer och endometriecancer är ungefär hälften närvarande med endometriecancer, vilket gör endometriecancer till den vanligaste sentinelcancer vid Lynch-syndrom. Det vanligaste symptomet på endometriecancer är onormal vaginal blödning. I HNPCC är medelåldern för diagnos av magcancer 56 år med tarm-adenokarcinom som den vanligaste rapporterade patologin. HNPCC-associerade äggstockscancer har en genomsnittlig diagnosålder på 42,5 år. cirka 30% diagnostiseras före 40 års ålder.
Betydande variation i cancerfrekvensen har hittats beroende på mutationen. Fram till 75 års ålder var riskerna för kolorektal cancer, endometriecancer, äggstockscancer, övre mag-tarmkanalen (gastrisk, duodenal, gallgång eller bukspottkörtel), urinvägscancer, prostatacancer och hjärntumörer följande: för MLH1-mutationer var risken var 46%, 43%, 10%, 21%, 8%, 17% respektive 1%; för MSH2-mutationer var riskerna 57%, 17%, 10%, 25%, 32% respektive 5%; för MSH6-mutationer var riskerna 15%, 46%, 13%, 7%, 11%, 18% respektive 1%.
| Gen | Risk för äggstockscancer | Endometriecancerrisk |
|---|---|---|
| MLH1 | 4-24% | 25-60% |
| MSH2 / EPCAM | 4-24% | 25-60% |
| MSH6 | 1-11% | 16-26% |
| PMS2 | 6% (kombinerad risk) | 15% |
Genetik

HNPCC ärvs på ett autosomalt dominerande sätt. Kännetecknet för HNPCC är felaktig reparation av DNA-felaktighet, vilket orsakar en förhöjd frekvens av enskilda nukleotidförändringar och mikrosatellitinstabilitet, även känd som MSI-H (H är ”hög”). MSI kan identifieras i cancerprover i patologilaboratoriet. De flesta fall resulterar i förändringar i längderna av dinukleotidupprepningar av nukleobaserna cytosin och adenin (sekvens: CACACACACA …).
De fyra huvudgenerna som är involverade i HNPCC kodar normalt för att proteiner som bildar dimerer ska fungera:
- MLH1-proteinet dimeriseras med PMS2-protein för att bilda MutLa, vilket samordnar bindningen av andra proteiner som är involverade i felaktig reparation som DNA-helikas, enkelsträngat DNA-bindningsprotein (RPA) och DNA-polymeraser.
- MSH2-protein dimeriseras med MSH6-protein, vilket identifierar felparningar via en glidklämmodell, ett protein för att söka efter fel.
Nedskrivningen av endera genen för proteindimeren försämrar proteinfunktionen. Dessa 4 gener är inblandade i felkorrigering (mismatch-reparation), så dysfunktion av generna kan leda till oförmågan att fixa DNA-replikationsfel och orsaka HNPCC. HNPCC är känt för att vara associerat med andra mutationer i gener som är involverade i DNA-felanpassningens
| OMIM-namn | Gener implicerade i HNPCC | Frekvensen av mutationer i HNPCC-familjer | Ställe | Första publikationen |
|---|---|---|---|---|
| HNPCC1 (120435) | MSH2 / EPCAM | cirka 60% | 2p22 | Fishel 1993 |
| HNPCC2 (609310) | MLH1 | cirka 30% | 3p21 | Papadopoulos 1994 |
| HNPCC5 | MSH6 | 7-10% | 2p16 | Miyaki 1997 |
| HNPCC4 | PMS2 | relativt sällsynt | 7p22 | Nicolaides 1994 |
| HNPCC3 | PMS1 | ärenderapport | 2q31-q33 | Nicolaides 1994 |
| HNPCC6 | TGFBR2 | ärenderapport | 3p22 | |
| HNPCC7 | MLH3 | ifrågasatt | 14q24.3 |
De flesta med HNPCC ärver tillståndet från en förälder. På grund av ofullständig penetration, varierande ålder för cancerdiagnos, minskad cancerrisk eller tidig död har emellertid inte alla personer med en HNPCC-genmutation en förälder som hade cancer. Vissa människor utvecklar HNPCC de-novo i en ny generation utan att ärva genen. Dessa människor identifieras ofta först efter att ha utvecklat en koloncancer i ett tidigt liv. Föräldrar med HNPCC har 50% chans att överföra den genetiska mutationen till varje barn. Det är också viktigt att notera att skadlig mutation i en av MMR-gener inte är tillräcklig för att orsaka cancer, utan att snarare ytterligare mutationer i andra tumörundertryckningsgener måste ske.
Diagnos av Lynch syndrom
En diagnos av Lynchs syndrom tillämpas på personer med en bakteriell DNA-mutation i en av MMR-generna (MLH1, MSH2, MSH6 och PMS2) eller EPCAM-genen, identifierad genom genetisk testning. Kandidater för bakteriell genetisk testning kan identifieras genom kliniska kriterier som Amsterdam Clinical Criteria och Bethesda Guidelines, eller genom tumöranalys genom immunhistokemi (IHC) eller mikrosatellitinstabilitet (MSI) -testning. I USA rekommenderar yrkesorganisationer att testa varje koloncancer för MSI eller IHC som screening för Lynch syndrom, men detta utförs inte alltid på grund av kostnads- och resursbegränsningar. Genetisk testning är kommersiellt tillgänglig och består av ett blodprov.
Immunohistokemi
Immunohistochemistry (IHC) är en metod som kan användas för att detektera abnormt mismatch reparation (MMR) proteinuttryck i tumörer som är associerade med Lynch syndrom. Även om det inte är diagnostiskt för ett Lynch-syndrom, kan det spela en roll för att identifiera människor som bör testa bakterier. Två metoder för implementering av IHC-test inkluderar åldersbaserad testning och universell testning för alla människor. För närvarande finns det inget omfattande avtal om vilken screeningmetod som ska användas. Åldersbaserad testning av IHC har föreslagits delvis på grund av kostnads-nyttoanalyser, medan universell testning för alla personer med kolorektal cancer säkerställer att personer med Lynch-syndrom inte missas. För att hantera kostnaderna försöker forskare att förutsäga MSI eller IHC direkt från hur tumören ser ut under mikroskopet utan att göra någon molekylär testning.
Microsatellite Instabilitet
Mutationer i DNA-felanpassningsreparationssystem kan leda till svårigheter att överföra regioner inom DNA som innehåller upprepande mönster av två eller tre nukleotider (mikrosatelliter), annars känd som mikrosatellitinstabilitet (MSI). MSI identifieras genom DNA-extraktion från både ett tumörvävnadsprov och ett normalt vävnadsprov följt av PCR-analys av mikrosatellitregioner. MSI-analys kan användas för att identifiera personer som kan ha Lynch syndrom och rikta dem för vidare testning.
Klassificering
Tre huvudgrupper av MSI-H (mikrosatellitinstabilitet – MSI) cancer kan kännas igen genom histopatologiska kriterier:
- höger sida dåligt differentierade cancerformer
- högersidiga slemhinnecancer
- adenokarcinom på vilken plats som helst som visar någon mätbar nivå av intraepitelial lymfocyt (TIL)
De histopatologiska kriterierna är inte känsliga nog för att upptäcka MSI från histologi men forskare försöker använda artificiell intelligens för att förutsäga MSI från histologi.
Dessutom kan HNPCC delas in i Lynch syndrom I (familjär koloncancer) och Lynch syndrom II (HNPCC associerad med andra cancerformer i mag-tarmkanalen eller reproduktionssystemet).
Förebyggande
Screening test
Genetisk rådgivning och genetisk testning rekommenderas för familjer som uppfyller Amsterdam-kriterierna, helst före början av koloncancer.
Koloncancer
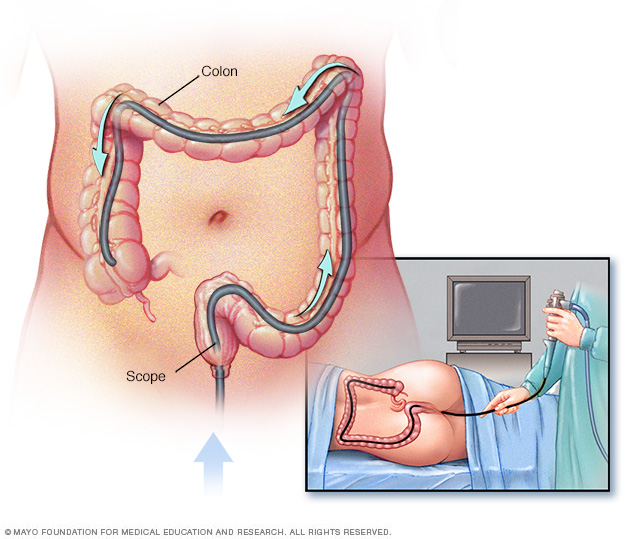
Koloskopier rekommenderas som en förebyggande övervakningsmetod för individer som har Lynch syndrom eller LS-associerade gener. Specifikt rekommenderas att koloskopier börjar vid 20–25 års ålder för MLH1- och MSH2-mutationsbärare och 35 år för MSH6- och PMS2-mutationsbärare. Kolonoskopisk övervakning ska sedan utföras med 1-2 års intervall för patienter med Lynch syndrom.
Endometriecancer / äggstockscancer
En transvaginal ultraljud med eller utan endometriebiopsi rekommenderas årligen för screening av äggstockscancer och endometriecancer. För kvinnor med Lynch-syndrom kan ett årligt CA-125-blodprov användas för att screena för äggstockscancer, men det finns begränsade data om effekten av detta test för att minska dödligheten.
Andra cancerformer
Det finns också strategier för att upptäcka andra cancerformer tidigt eller minska risken för att utveckla dem som personer med Lynch syndrom kan diskutera med sin läkare, men deras effektivitet är inte tydlig. Dessa alternativ inkluderar:
- Övre endoskopier för att upptäcka mag- och tunntarmscancer vart tredje till femte år, tidigast vid 30 års ålder (helst i en forskningsinställning)
- Årlig urinanalys för att upptäcka urinblåsecancer, tidigast från 30 års ålder (helst i en forskningsinställning)
- Årliga fysiska och neurologiska undersökningar för att upptäcka cancer i centrala nervsystemet (hjärna eller ryggmärg), tidigast vid 25 års ålder
Amsterdam-kriterier
Följande är Amsterdam-kriterierna för att identifiera högrisk kandidater för molekylär genetisk testning:
Amsterdam I-kriterier (alla punkter måste uppfyllas):
- Tre eller flera familjemedlemmar med en bekräftad diagnos av kolorektal cancer, varav en är en första grad (förälder, barn, syskon) släkting till de andra två
- Två på varandra följande generationer
- En eller flera tjocktarmscancer diagnostiserade under 50 års ålder
- Familjell adenomatös polypos (FAP) har uteslutits
Amsterdam II-kriterierna utvecklades 1999 och förbättrade den diagnostiska känsligheten för Lynch syndrom genom att inkludera cancer i endometrium, tunntarm, urinledare och njurbäcken.
Amsterdam Criteria II (alla punkter måste uppfyllas):
- Tre eller flera familjemedlemmar med HNPCC-relaterade cancerformer, varav den ena är första gradens släkting till de andra två
- Två på varandra berörda generationer
- En eller flera av de HNPCC-relaterade cancerformerna diagnostiserade under 50 år
- Familjell adenomatös polypos (FAP) har uteslutits
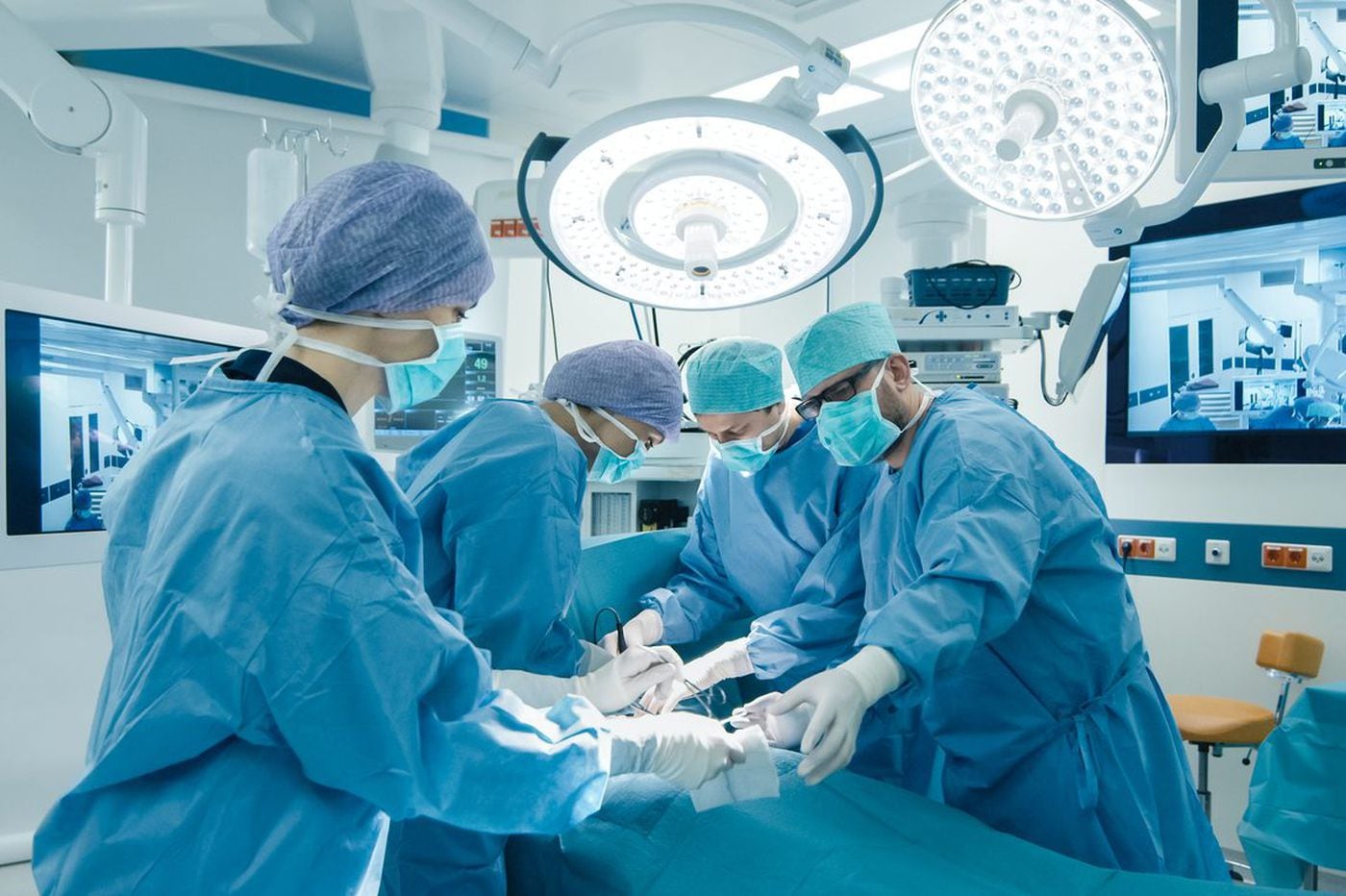
Kirurgi
Profylaktisk hysterektomi och salpingo-oophorektomi (avlägsnande av livmodern, äggledarna och äggstockarna för att förhindra att cancer utvecklas) kan utföras innan äggstockscancer eller endometriecancer utvecklas.
Behandling av Lynch syndrom
Kirurgi är fortfarande den främsta behandlingen för HNPCC. Patienter med Lynch-syndrom som utvecklar kolorektal cancer kan behandlas med antingen en partiell kolektomi eller total kolektomi med ileorektal anastomos. På grund av ökad risk för kolorektal cancer efter partiell kolektomi och liknande livskvalitet efter båda operationerna kan en total kolektomi vara en föredragen behandling för HNPCC, särskilt hos yngre patienter.
Det pågår en pågående kontrovers över fördelen med 5-fluorouracil-baserade adjuvansbehandlingar för HNPCC-relaterade kolorektala tumörer, särskilt de i steg I och II.
- Anti-PD-1-antikroppsterapi kan vara effektiv.
Kontrollpunktsblockad med anti-PD-1-behandling är nu att föredra förstahandsbehandling för avancerad mikrosatellit-instabilitet – hög kolorektal cancer.
.