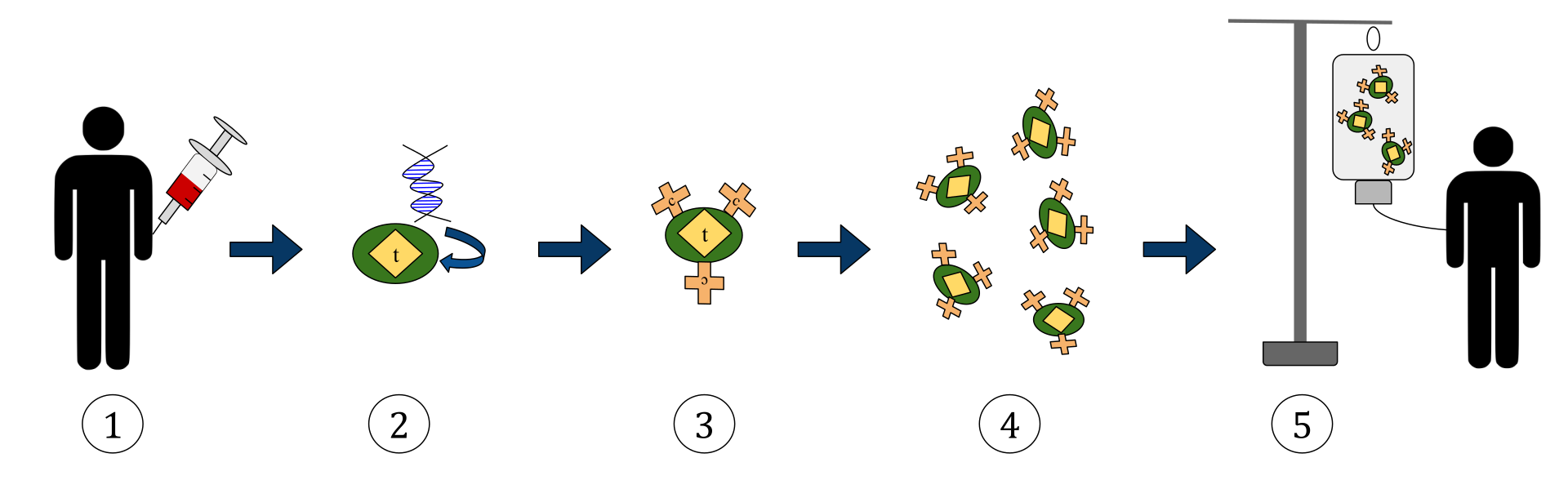
Diagrammet ovan representerar processen för chimär antigenreceptor T-cellterapi (CAR). Detta är en metod för immunterapi, som är en växande praxis vid behandling av cancer. Det slutliga resultatet bör vara en produktion av utrustade T-celler som kan känna igen och bekämpa de infekterade cancercellerna i kroppen.
1. T-celler (representerade av föremål märkta som ’t’) avlägsnas från patientens blod.
2. Därefter införlivas genen som kodar för de specifika antigenreceptorerna i ett laboratorium i T-cellerna.
3. Således producerar CAR-receptorerna (märkta som c) på cellernas yta.
4. De nyligen modifierade T-cellerna skördas sedan vidare och odlas i laboratoriet.
5. Efter en viss tidsperiod infunderas de konstruerade T-cellerna tillbaka till patienten.
Chimära antigenreceptor-T-celler (också känd som CAR T-celler) är T-celler som har konstruerats genetiskt för att producera en artificiell T-cellreceptor för användning vid immunterapi.
Chimära antigenreceptorer (BILAR, också känd som chimära immunreceptorer, chimära T-cellreceptorer, eller konstgjorda T-cellreceptorer) är receptorproteiner som har konstruerats för att ge T-celler den nya förmågan att rikta in sig på ett specifikt protein. Receptorerna är chimära eftersom de kombinerar både antigenbindande och T-cellaktiverande funktioner till en enda receptor.
CAR-T-cellterapi använder T-celler konstruerade med CAR för cancerterapi. Utgångspunkten för CAR-T-immunterapi är att modifiera T-celler för att känna igen cancerceller för att mer effektivt rikta in dem och förstöra dem. Forskare skördar T-celler från människor, förändrar dem genetiskt och infunderar sedan de resulterande CAR-T-cellerna i patienter för att attackera deras tumörer. CAR-T-celler kan antingen härledas från T-celler i patientens eget blod (autologt) eller härledas från T-celler från en annan frisk donator (allogen). När de väl är isolerade från en person, är dessa T-celler genetiskt konstruerade för att uttrycka en specifik bil, som programmerar dem för att rikta sig mot ett antigen som finns på ytan av tumörer. För säkerhet är CAR-T-celler konstruerade för att vara specifika för ett antigen som uttrycks på en tumör som inte uttrycks på friska celler.
Efter att CAR-T-celler har infunderats i en patient fungerar de som ett ”levande läkemedel” mot cancerceller. När de kommer i kontakt med sitt riktade antigen på en cell binder CAR-T-celler till det och aktiveras, fortsätter sedan att sprida sig och bli cytotoxiska. CAR-T-celler förstör celler genom flera mekanismer, inklusive omfattande stimulerad cellproliferation, vilket ökar graden i vilken de är giftiga för andra levande celler (cytotoxicitet) och genom att orsaka den ökade utsöndringen av faktorer som kan påverka andra celler såsom cytokiner, interleukiner och tillväxtfaktorer.
Produktion av CAR-T-celler

Det första steget i produktionen av CAR-T-celler är isoleringen av T-celler från humant blod. CAR-T-celler kan tillverkas antingen från patientens eget blod, känt som en autolog behandling, eller från blodet från en frisk donator, känd som en allogen behandling. Tillverkningsprocessen är densamma i båda fallen; endast valet av initial blodgivare är annorlunda.
Först isoleras leukocyter med användning av en blodcellsavskiljare i en process som kallas leukocytaferes. Perifera mononukleära blodceller (PBMC) separeras sedan och samlas upp. Produkterna av leukocytaferes överförs sedan till ett cellbehandlingscenter. I cellbehandlingscentret stimuleras specifika T-celler så att de aktivt kommer att sprida sig och expandera till stort antal. För att driva deras expansion behandlas T-celler typiskt med cytokininterleukin 2 (IL-2) och anti-CD3-antikroppar.
De expanderade T-cellerna renas och transduceras sedan med en gen som kodar den konstruerade CAR via en retroviral vektor, typiskt antingen en integrerande gammaretrovirus (RV) eller en lentiviral (LV) vektor. Dessa vektorer är mycket säkra i modern tid på grund av en delvis radering av U3-regionen. Det nya genredigeringsverktyget CRISPR / Cas9 har nyligen använts istället för retrovirala vektorer för att integrera CAR-genen i specifika platser i genomet.
Patienten genomgår kemoterapi med lymfförmåga innan introduktionen av de konstruerade CAR-T-cellerna. Tömningen av antalet cirkulerande leukocyter i patienten reglerar antalet cytokiner som produceras och minskar konkurrensen om resurser, vilket hjälper till att främja expansionen av de konstruerade CAR-T-cellerna.
Kliniska tillämpningar
Från och med mars 2019 pågick cirka 364 pågående kliniska prövningar globalt med CAR-T-celler. Majoriteten av dessa studier riktar sig till blodcancer: CAR-T-terapier står för mer än hälften av alla studier för hematologiska maligniteter. CD19 fortsätter att vara det mest populära antigenmålet, följt av BCMA (vanligtvis uttryckt i multipelt myelom). År 2016 började studier att undersöka livskraften hos andra antigener, såsom CD20. Försök för fasta tumörer domineras mindre av CAR-T, med ungefär hälften av cellterapibaserade försök som involverar andra plattformar som NK-celler.
Cancer
T-celler är genetiskt konstruerade för att uttrycka chimära antigenreceptorer specifikt riktade mot antigener på en patients tumörceller, sedan infunderas i patienten där de attackerar och dödar cancercellerna. Adoptiv överföring av T-celler som uttrycker CARs är en lovande anti-cancerterapi, eftersom CAR-modifierade T-celler kan konstrueras för att rikta in sig på praktiskt taget alla tumörassocierade antigener.
Tidig CAR-T-cellforskning har fokuserat på blodcancer. De första godkända behandlingarna använder bilar som riktar sig mot antigenet CD19, närvarande i B-cell-härledda cancerformer såsom akut lymfoblastisk leukemi (ALL) och diffust stort B-celllymfom (DLBCL). Det pågår också ansträngningar för att konstruera bilar som riktar sig mot många andra blodcancerantigener, inklusive CD30 i eldfast Hodgkins lymfom; CD33, CD123 och FLT3 vid akut myeloid leukemi (AML); och BCMA vid multipelt myelom.
Solida tumörer har presenterat ett svårare mål. Identifiering av bra antigener har varit utmanande: sådana antigener måste uttryckas starkt på majoriteten av cancerceller, men i stort sett frånvarande i normala vävnader. CAR-T-celler trafikeras inte heller effektivt in i mitten av solida tumörmassor, och den fientliga tumörmikromiljön undertrycker T-cellaktivitet.
Autoimmun sjukdom
Medan de flesta CAR T-cellstudier fokuserar på att skapa en CAR T-cell som kan utrota en viss cellpopulation (till exempel CAR T-celler som riktar sig till lymfomceller), finns det andra potentiella användningsområden för denna teknik. T-celler kan också skydda självantigener från autoimmuna reaktioner. En regulatorisk T-cell utrustad med en CAR kan ha potential att ge tolerans mot ett specifikt antigen, något som kan användas vid organtransplantation eller reumatiska sjukdomar som lupus.
Satefy
Det finns allvarliga biverkningar som beror på att CAR-T-celler införs i kroppen, inklusive cytokinfrisättningssyndrom och neurologisk toxicitet. Eftersom det är en relativt ny behandling finns det få data om de långsiktiga effekterna av CAR-T-cellterapi. Det finns fortfarande oro över långvarig patientöverlevnad, liksom graviditetskomplikationer hos kvinnliga patienter som behandlas med CAR-T-celler. Anafylaksi är en förväntad biverkning, eftersom CAR är tillverkad med en främmande monoklonal antikropp och som ett resultat framkallar ett immunsvar.
On / target-igenkänning inträffar när CAR-T-cellen känner igen rätt antigen, men antigenet uttrycks på frisk, icke-patogen vävnad. Detta resulterar i att CAR-T-celler attackerar icke-tumörvävnad, såsom friska B-celler som uttrycker CD19. Svårighetsgraden av denna negativa effekt kan variera från B-cell aplasi, som kan behandlas med stödjande infusioner, till extrem toxicitet som leder till döden.
Det finns också den osannolika möjligheten att de konstruerade CAR-T-cellerna själva kommer att transformeras till cancerceller genom insättningsmutagenes på grund av att den virala vektorn infogar CAR-genen i en tumörundertryckare eller onkogen i värd-T-cellens genom. Vissa retrovirala (RV) vektorer bär en lägre risk än lentivirala (LV) vektorer. Båda har dock potential att vara onkogena. Genomisk sekvenseringsanalys av CAR-insättningsställen i T-celler har fastställts för bättre förståelse av CAR T-cellfunktion och uthållighet in vivo.
Cytokinfrisättningssyndrom
Det vanligaste problemet efter behandling med CAR-T-celler är cytokinfrisättningssyndrom (CRS), ett tillstånd där immunsystemet aktiveras och frigör ett ökat antal inflammatoriska cytokiner. Den kliniska manifestationen av detta syndrom liknar sepsis med hög feber, trötthet, myalgi, illamående, kapillärläckage, takykardi och annan hjärtdysfunktion, leversvikt och nedsatt njurfunktion. CRS förekommer hos nästan alla patienter som behandlas med CAR-T-cellterapi; faktiskt är närvaron av CRS en diagnostisk markör som indikerar att CAR-T-cellerna fungerar som avsedda för att döda cancercellerna. Observera dock att en högre grad av CRS-svårighetsgrad inte korrelerar med ett ökat svar på behandlingen utan snarare högre sjukdomsbörda.
Immuneffektorcellassocierad neurotoxicitet
Neurologisk toxicitet är också ofta förknippad med CAR-T-cellbehandling. Den underliggande mekanismen är dåligt förstådd och kan eller kanske inte är relaterad till CRS. Kliniska manifestationer inkluderar delirium, partiell förlust av förmågan att tala sammanhängande medan man fortfarande har förmågan att tolka språk (uttrycksfull afasi), sänkt vakenhet (obtundation) och kramper. Under vissa kliniska prövningar har dödsfall orsakats av neurotoxicitet inträffat. Den främsta dödsorsaken på grund av neurotoxicitet är cerebralt ödem. I en studie utförd av Juno Therapeutics, Inc. dog fem patienter som deltog i studien till följd av hjärnödem. Två av patienterna behandlades med enbart cyklofosfamid och de återstående tre behandlades med en kombination av cyklofosfamid och fludarabin. I en annan klinisk prövning sponsrad av Fred Hutchinson Cancer Research Center, rapporterades ett fall av irreversibel och dödlig neurologisk toxicitet 122 dagar efter administrering av CAR-T-celler.
.
















