Glukagon är ett peptidhormon som produceras av alfa-celler i bukspottkörteln. Glukagon ökar koncentrationen av glukos och fettsyror i blodomloppet och anses vara det viktigaste kataboliska hormonet i kroppen. Glucagon används också som ett läkemedel för att behandla ett antal hälsotillstånd. Effekten av glukagon är motsatt den för insulin, vilket sänker extracellulärt glukos. Glukagon produceras från proglukagon, kodad av GCG-genen.
Bukspottkörteln släpper ut glukagon när mängden glukos i blodomloppet är för låg. Glukagon får levern att delta i glykogenolys: omvandla lagrad glykogen till glukos, som släpps ut i blodomloppet. Höga blodglukosnivåer stimulerar däremot frisättningen av insulin. Insulin gör att glukos kan tas upp och användas av insulinberoende vävnader. Således är glukagon och insulin en del av ett återkopplingssystem som håller blodsockernivån stabil. Glucagon ökar energiförbrukningen och höjs under stressförhållanden. Glukagon tillhör secretinfamiljen av hormoner.
Glukagonens funktion
Glukagon höjer i allmänhet koncentrationen av glukos i blodet genom att främja glukoneogenes och glykogenolys. Glukagon minskar också fettsyrasyntesen i fettvävnad och levern. Glucagon främjar lipolys i dessa vävnader, vilket får dem att släppa ut fettsyror i cirkulation där de kan kataboliseras för att generera energi i vävnader såsom skelettmuskler vid behov.
Glukos lagras i levern i form av polysackaridglykogen, som är en glukan (en polymer som består av glukosmolekyler). Leverceller (hepatocyter) har glukagonreceptorer. När glukagon binder till glukagonreceptorerna omvandlar levercellerna glykogen till enskilda glukosmolekyler och släpper ut dem i blodomloppet, i en process som kallas glykogenolys. När glukosförvaring tappas uppmuntrar glukagon sedan levern och njuren att syntetisera ytterligare glukos genom glukoneogenes. Glukagon stänger av glykolys i levern, vilket gör att glykolytiska mellanprodukter förflyttas till glukoneogenes.
Glukagon reglerar också graden av glukosproduktion genom lipolys. Glucagon inducerar lipolys hos människor under insulinsuppression (såsom diabetes mellitus typ 1).
Glukagonproduktion verkar vara beroende av det centrala nervsystemet genom vägar som ännu inte definierats. Hos ryggradslösa djur har avlägsnande av ögonsträngar rapporterats påverka glukagonproduktionen. Skärning av ögonstången hos unga kräftor producerar glukagoninducerad hyperglykemi.
Verkningsmekanism för glukagon
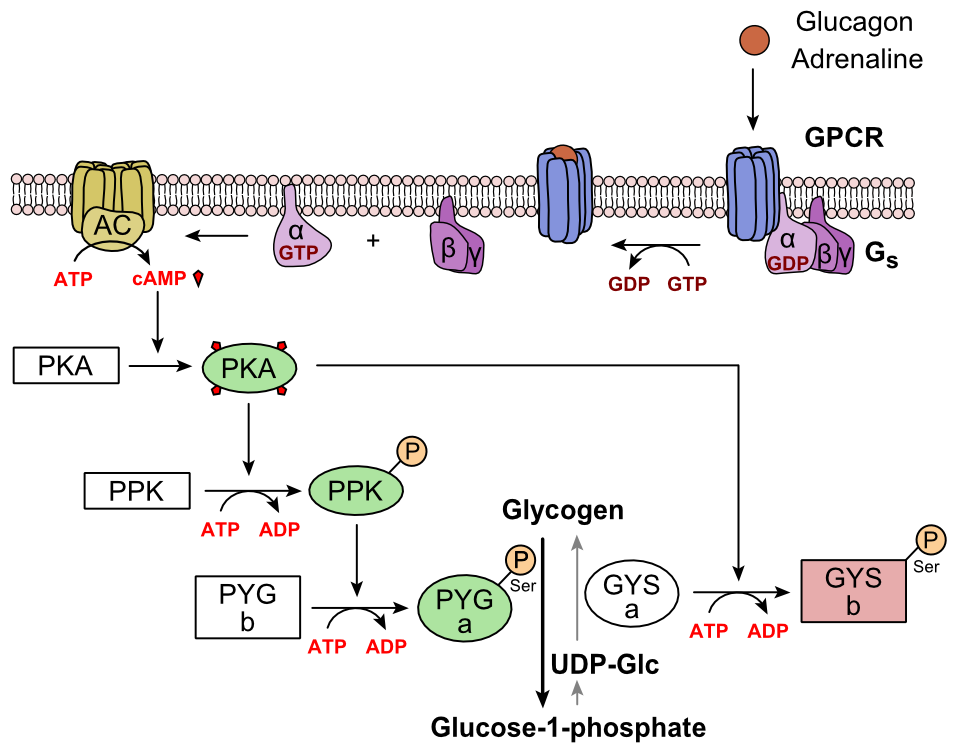
Glukagon binder till glukagonreceptorn, en G-proteinkopplad receptor, lokaliserad i cellens plasmamembran. Konformationsförändringen i receptorn aktiverar G-proteiner, ett heterotrimert protein med a-, P- och y-underenheter. När G-proteinet interagerar med receptorn genomgår det en konformationsförändring som resulterar i utbyte av BNP-molekylen som var bunden till α-underenheten med en GTP-molekyl. Denna substitution resulterar i frisättning av a-underenheten från p- och y-underenheterna. Alfa-subenheten aktiverar specifikt nästa enzym i kaskaden, adenylatcyklas.
Adenylatcyklas tillverkar cykliskt adenosinmonofosfat (cykliskt AMP eller cAMP), vilket aktiverar proteinkinas A (cAMP-beroende proteinkinas). Detta enzym aktiverar i sin tur fosforylaskinas, som sedan fosforylerar glykogenfosforylas b (PYG b) och omvandlar det till den aktiva form som kallas fosforylas a (PYG a). Fosforylas a är det enzym som är ansvarigt för frisättningen av glukos 1-fosfat från glykogenpolymerer.
Ett exempel på vägen skulle vara när glukagon binder till ett transmembranprotein. Transmembranproteinerna interagerar med Gp3. G2 separeras från Gp3 och interagerar med transmembranproteinet adenylylcyklas. Adenylylcyklas katalyserar omvandlingen av ATP till cAMP. cAMP binder till proteinkinas A och det komplexa fosforylerar fosforylaskinas. Fosforylerat fosforylas-kinas fosforylerar fosforylas. Fosforylerat fosforylas klipper glukosenheter från glykogen som glukos 1-fosfat.
Dessutom justeras den samordnade kontrollen av glykolys och glukoneogenes i levern genom fosforyleringstillståndet hos enzymerna som katalyserar bildandet av en potent glykolysaktivator som kallas fruktos 2,6-bisfosfat. Enzymproteinkinas A (PKA) som stimulerades av kaskaden initierad av glukagon fosforylerar också en enda serinrest i den bifunktionella polypeptidkedjan som innehåller både enzymerna fruktos 2,6-bisfosfatas och fosfofruktokinas-2. Denna kovalenta fosforylering initierad av glukagon aktiverar den förstnämnda och hämmar den senare. Detta reglerar reaktionskatalyserande fruktos 2,6-bisfosfat (en potent aktivator av fosfofruktokinas-1, enzymet som är det primära regleringssteget för glykolys) genom att sakta ner bildningshastigheten och därigenom hämma flödet av glykolysvägen och möjliggöra glukoneogenes att dominera. Denna process är reversibel i frånvaro av glukagon (och därmed närvaron av insulin).
Glukagonstimulering av PKA inaktiverar också det glykolytiska enzymet pyruvatkinas i hepatocyter.
Fysiologi
Glukagonproduktion
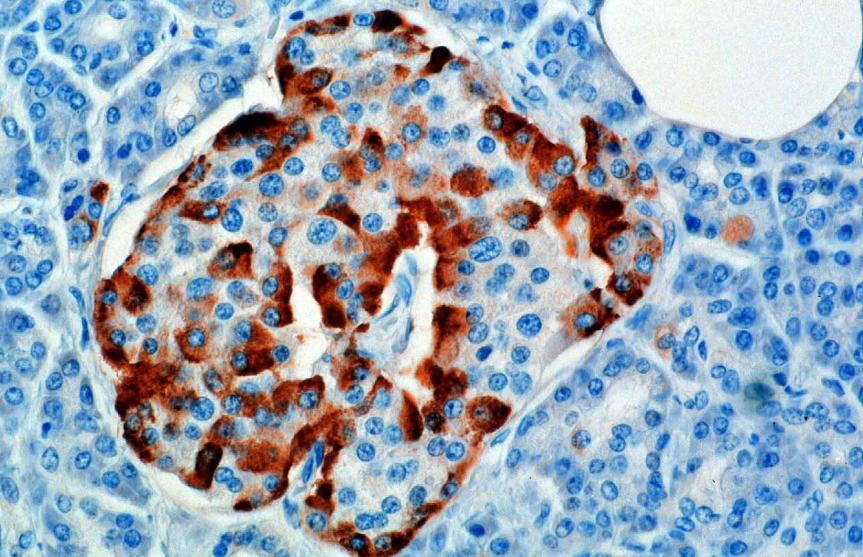
Hormonet syntetiseras och utsöndras från alfa-celler (α-celler) i Langerhans-öarna, som ligger i den endokrina delen av bukspottkörteln. Produktion, som i övrigt är frikörande, undertrycks / regleras av amylin, ett peptidhormon som co-utsöndras med insulin från bukspottkörtelns β-celler. När plasmaglukosnivåerna minskar, minskar den efterföljande minskningen av amylinsekretion dess undertryckande av a-cellerna, vilket möjliggör glukagonutsöndring.
Hos gnagare är alfacellerna placerade i den yttre kanten av holmen. Mänsklig holmstruktur är mycket mindre segregerad, och alfa-celler fördelas genom hela holmen i närheten av betaceller. Glukagon produceras också av alfa-celler i magen.
Ny forskning har visat att glukagonproduktion också kan äga rum utanför bukspottkörteln, där tarmen är det mest troliga stället för glukagonsyntes i bukspottkörteln.
Glukagonreglering
Sekretion av glukagon stimuleras av:
- Hypoglykemi
- Epinefrin (via β2-, α2- och α1-adrenerga receptorer)
- Arginin
- Alanin (ofta från muskelhärledd pyruvat / glutamattransaminering
- Acetylkolin
- Kolecystokinin
- Maghämmande polypeptid
Sekretion av glukagon hämmas av:
- Somatostatin
- Amylin
- Insulin (via GABA)
- PPARy / retinoid X-receptor heterodimer.
- Ökade fria fettsyror och ketosyror i blodet.
- Ökad karbamidproduktion
- Glukagonliknande peptid-1
Glukagon struktur
Glukagon är en 29-aminosyrapolypeptid. Dess primära struktur hos människor är: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp -Leu-Met-Asn-Thr-COOH.
Polypeptiden har en molekylvikt av 3485 dalton. Glukagon är ett peptid (nonsteroid) hormon.
Glukagon genereras från klyvning av proglukagon av proproteinkonvertas 2 i a-celler i bukspottkörteln. I intestinala L-celler klyvs proglukagon till de alternativa produkterna glicentin, GLP-1 (ett inkretin), IP-2 och GLP-2 (främjar tarmtillväxt).
Patologi
Onormalt förhöjda nivåer av glukagon kan orsakas av tumörer i bukspottkörteln, såsom glukagonoma, vars symtom inkluderar nekrolytisk migrerande erytem, reducerade aminosyror och hyperglykemi. Det kan förekomma ensamt eller i samband med multipel endokrin neoplasi typ 1.
Förhöjt glukagon är den främsta bidragsgivaren till hyperglykemisk ketoacidos vid odiagnostiserad eller dåligt behandlad typ 1-diabetes. Eftersom betacellerna upphör att fungera, är insulin och bukspottkörteln GABA inte längre närvarande för att undertrycka det frilöpande resultatet av glukagon. Som ett resultat frigörs glukagon från alfa-cellerna maximalt, vilket orsakar en snabb nedbrytning av glykogen till glukos och snabb ketogenes. Det visade sig att en delmängd av vuxna med typ 1-diabetes i genomsnitt tog fyra gånger längre tid att närma sig ketoacidos när de fick somatostatin (hämmar glukagonproduktionen) utan insulin. Att hämma glukagon har varit en populär idé om diabetesbehandling, men vissa har varnat för att detta kommer att ge upphov till spröd diabetes hos patienter med tillräckligt stabil blodglukos.
Frånvaron av alfaceller (och därmed glukagon) anses vara en av de viktigaste influenserna i den extrema volatiliteten hos blodglukos i samband med en total pankreatektomi.
Historia
På 1920-talet studerade Kimball och Murlin bukspottkörtelextrakt och fann en ytterligare substans med hyperglykemiska egenskaper. De beskrev glukagon 1923. Aminosyrasekvensen för glukagon beskrevs i slutet av 1950-talet. En mer fullständig förståelse för dess roll i fysiologi och sjukdom fastställdes inte förrän på 1970-talet, då en specifik radioimmunanalys utvecklades.
.
















