| Alfa-amylas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
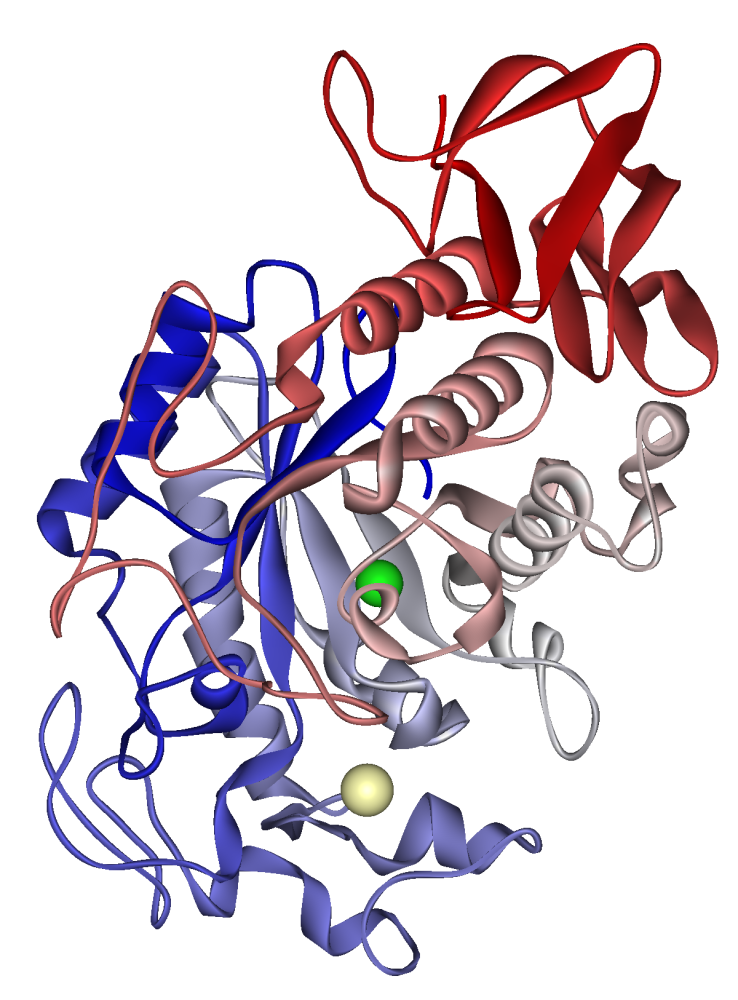
Humant salivamylas: kalciumjon synlig i blek kaki, kloridjon i grönt. FBF 1SMD
|
|||||||||
| Identifierare | |||||||||
| EG-nr | 3.2.1.0 | ||||||||
| CAS-nr. | 9000-90-2 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA-post | ||||||||
| EXPASy | Utsikt över NiceZyme | ||||||||
| KEGG | KEGG-post | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| FBF-strukturer | RCSB PDB PDBe PDBsum | ||||||||
|
|||||||||
| GH13-katalytisk domän | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Cyklodextrin glukanotransferas (ec2.4.1.19) (cgtas)
|
|||||||||
| Identifierare | |||||||||
| Symbol | Alfa-amylas | ||||||||
| Pfam | PF00128 | ||||||||
| Pfam-klan | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| OPM-superfamilj | 117 | ||||||||
| OPM-protein | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Alpha-amylas C-terminal beta-ark domän | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Kristallstruktur av korn alfa-amylas isozym 1 (amy1) inaktiv mutant d180a i komplex med maltoheptaos
|
|||||||||
| Identifierare | |||||||||
| Symbol | Alpha-amyl_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alpha-amylas, C-terminal all-beta-domän | |||||||||
|---|---|---|---|---|---|---|---|---|---|
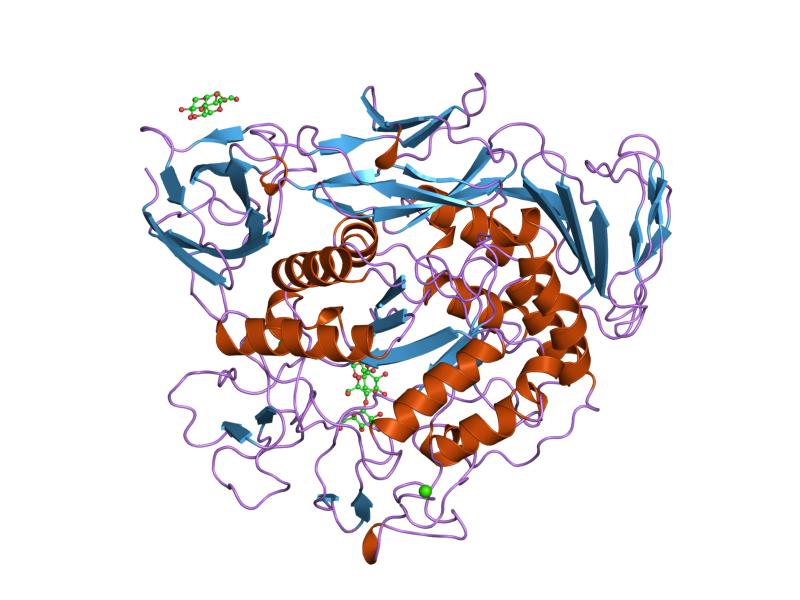
maltotrioskomplex av förkonditionerat cyklodextrin-glykosyltransferasmutant
|
|||||||||
| Identifierare | |||||||||
| Symbol | Alfa-amylas_C | ||||||||
| Pfam | PF02806 | ||||||||
| Pfam-klan | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Alfa-amylas, (a-amylas) är ett enzym EC 3.2.1.1 som hydrolyserar alfa-bindningar av stora, alfa-bundna polysackarider, såsom stärkelse och glykogen, vilket ger kortare kedjor därav, dextriner och maltos. Det är den viktigaste formen av amylas som finns hos människor och andra däggdjur. Det finns också i frön som innehåller stärkelse som matreserv och utsöndras av många svampar. Det är en medlem av glykosidhydrolasfamiljen 13.
I mänsklig biologi
Även om det finns i många vävnader är amylas mest framträdande i bukspottkörteljuice och saliv, var och en har sin egen isoform av humant α-amylas. De beter sig annorlunda vid isoelektrisk fokusering och kan också separeras vid testning genom att använda specifika monoklonala antikroppar. Hos människor länkar alla amylas-isoformer till kromosom 1p21 (se AMY1A).
Salivary amylas (ptyalin)
Amylas finns i saliv och bryter stärkelse i maltos och dextrin. Denna form av amylas kallas också ”ptyalin” /ˈtaɪəlɪn/, som namngavs av den svenska kemisten Jöns Jacob Berzelius. Namnet kommer från det grekiska ordet πτυω (jag spottade), eftersom ämnet erhölls från saliv. Det kommer att bryta stora, olösliga stärkelsemolekyler i lösliga stärkelser (amylodextrin, erytrodextrin och achrodextrin) och producera successivt mindre stärkelse och slutligen maltos. Ptyalin verkar på linjära α (1,4) glykosidbindningar, men hydrolys av föreningar kräver ett enzym som verkar på grenade produkter. Salivary amylas inaktiveras i magen av magsyra. I magsaft justerad till pH 3,3 inaktiverades ptyalin totalt på 20 minuter vid 37 ° C. Däremot förblev 50% av amylasaktiviteten efter 150 minuters exponering för magsaft vid pH 4,3. Både stärkelse, substratet för ptyalin och produkten (korta kedjor av glukos) kan delvis skydda det mot inaktivering av magsyra. Ptyalin tillsatt till buffert vid pH 3,0 genomgick fullständig inaktivering på 120 minuter; emellertid resulterade tillsats av stärkelse vid en 0,1% -nivå i 10% av återstående aktivitet, och liknande tillsats av stärkelse till en 1,0% -nivå resulterade i att cirka 40% av aktiviteten förblev vid 120 minuter.
Optimala förhållanden för ptyalin
- Optimalt pH – 7,0
- Människokroppstemperatur
- Förekomst av vissa anjoner och aktivatorer:
- Klorid och bromid – mest effektiva
- Jod – mindre effektiv
- Sulfat och fosfat – minst effektivt
Genetisk variation i humant salivamylas
Spytamylasgenen har genomgått duplicering under evolutionen, och DNA-hybridiseringsstudier visar att många individer har flera tandemupprepningar av genen. Antalet genkopior korrelerar med nivåerna av salivamylas, mätt med proteinblottanalyser med antikroppar mot humant amylas. Genkopianummer är associerat med uppenbar evolutionär exponering för dieter med hög stärkelse. Till exempel hade en japansk individ 14 kopior av amylasgenen (en allel med 10 kopior och en andra allel med fyra kopior). Den japanska kosten har traditionellt innehöll stora mängder risstärkelse. Däremot hade en Biaka-person sex exemplar (tre kopior på varje allel). Biaka är regnskogsjägare som traditionellt har konsumerat en diet med låg stärkelse. Perry och kollegor spekulerade i att det ökade antalet kopior av salivamylasgenen kan ha ökat överlevnaden sammanfallande till en övergång till en stärkelsekost under människans utveckling.
Pankreasamylas
Bukspottkörtelns a-amylas klyver slumpmässigt a (1-4) glykosidbindningarna av amylos för att ge dextrin, maltos eller maltotriose. Den antar en dubbel förskjutningsmekanism med bibehållande av den anomera konfigurationen. Hos människor utvecklades salivamylaset från en kopia av det.
I patologi
Testet för amylas är lättare att utföra än för lipas, vilket gör det till det primära testet som används för att upptäcka och övervaka pankreatit. Medicinska laboratorier mäter vanligtvis antingen pankreasamylas eller totalt amylas. Om endast amylas i bukspottkörteln mäts, kommer en ökning inte att noteras med påssjuka eller annat spottkörtelstrauma.
På grund av den lilla mängden som är närvarande är tidpunkten dock avgörande när blodprov tas för denna mätning. Blod bör tas strax efter en smärta av pankreatit, annars utsöndras det snabbt av njurarna.
Spyt α-amylas har använts som en biomarkör för stress och som en surrogatmarkör för sympatisk nervsystem (SNS) aktivitet som inte kräver blodtryck.
Tolkning
Ökade plasmanivåer hos människor finns i:
- Spyttstrauma (inklusive bedövningsintubation)
- Påssjuka – på grund av inflammation i spottkörtlarna
- Pankreatit – på grund av skador på cellerna som producerar amylas
- Njursvikt – på grund av minskad utsöndring
Totala amylasavläsningar över 10 gånger den övre normalgränsen (ULN) tyder på pankreatit. Fem till tio gånger ULN kan indikera ileus eller tolvfingertarmsjukdom eller njursvikt, och lägre höjder finns vanligtvis i spottkörtelsjukdom.
Gener
- salivary – AMY1A, AMY1B, AMY1C
- bukspottkörteln – AMY2A, AMY2B
I spannmål
α-amylasaktivitet i spannmål mäts med t.ex. Hagberg – Perten Falling Number, ett test för att bedöma groddeskador eller Phadebas-metoden. Finns i vete.
Industriell användning
α-amylas används vid etanolproduktion för att bryta stärkelse i korn till jäsbara sockerarter.
Det första steget i produktionen av majssirap med hög fruktos är behandlingen av majsstärkelse med α-amylas, vilket ger kortare kedjor av sockerarter oligosackarider.
Ett α-amylas som heter ”Termamyl”, kommer från Bacillus licheniformis, används också i vissa tvättmedel, särskilt diskmedel och stärkande avlägsnande tvättmedel.
Se amylas för mer användning av amylasfamiljen i allmänhet.
Potential för medicinskt bruk
a-amylas har uppvisat effektivitet vid nedbrytning av polymikrobiella bakteriefilmer genom hydrolys av α (1-4) glykosidbindningar i de strukturella, matrixxopolysackariderna hos den extracellulära polymera substansen (EPS).
Bufferthämning
Tris-molekylen rapporteras hämma ett antal bakteriella α-amylaser, så de ska inte användas i tris-buffert.
Bestämning
Flera metoder är tillgängliga för bestämning av a-amylasaktivitet, och olika industrier tenderar att förlita sig på olika metoder. Stärkelsejodtestet, en utveckling av jodtestet, är baserat på färgförändring, eftersom α-amylas bryter ner stärkelse och används ofta i många applikationer. Ett liknande men industriellt producerat test är Phadebas-amylas-testet, som används som ett kvalitativt och kvantitativt test inom många industrier, såsom rengöringsmedel, olika mjöl-, spannmål- och maltmatar och kriminalteknisk biologi.
Domänarkitektur
a-amylaser innehåller ett antal distinkta proteindomäner. Den katalytiska domänen har en struktur som består av en åtta-strängad alfa / beta-fat som innehåller det aktiva stället, avbrutet av en ~ 70-aminosyra kalciumbindande domän som sticker ut mellan beta-streng 3 och alfa-helix 3 och en karboxyl-terminal grekisk nyckel beta-tunndomän. Flera alfa-amylaser innehåller en beta-arkdomän, vanligtvis vid C-änden. Denna domän är organiserad som ett femsträngat antiparallellt beta-ark. Flera alfa-amylaser innehåller en all-beta-domän, vanligtvis vid C-änden.
.
















